KClO3 → KCl + O2 là phản xạ phân bỏ. Bài viết lách này hỗ trợ khá đầy đủ vấn đề về phương trình chất hóa học đã và đang được thăng bằng, ĐK những hóa học nhập cuộc phản xạ, hiện tượng lạ (nếu có),bên cạnh đó tất nhiên một số trong những bài xích luyện tương quan đem đáp án. Từ cơ, canh ty những em nắm rõ kỹ năng và kiến thức phần này. Mời chúng ta đón xem:
Phản ứng KClO3 → KCl + O2
Bạn đang xem: KClO3 → KCl + O2 | KClO3 ra KCl | KClO3 ra O2
1. Phương trình sức nóng phân KClO3
2KClO3 2KCl + 3O2
2. Điều khiếu nại phản xạ KClO3 đi ra KCl
Nhiệt độ
3. Bản hóa học của KClO3 (Kali clorat) nhập phản ứng
Ở sức nóng chừng 500℃ KClO3 bị phân bỏ trở thành muối bột kali clorua và oxI. Phản ứng này trọn vẹn rất có thể xẩy ra ở sức nóng chừng thấp rộng lớn nếu như dùng MnO2 thực hiện hóa học xúc tác.
4. Mở rộng lớn về KClO3
4.1.Tính hóa chất của kali clorat
Là một hóa học lão hóa mạnh, rất có thể ứng dụng với tương đối nhiều phi kim và sắt kẽm kim loại như cacbon, photpho, nhôm, lưu hoàng, magie,…
2KClO3 + 3S → 2KCl + 3SO2
KClO3 + 3Mg → KCl + 3MgO
5KClO3 + 6P → 5KCl + 3P2O5
Các phương trình phản xạ khác:
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
2KClO3 + 3MnO2→ 2KMnO4 + MnCl2 + 2O2
KClO3 + 3H2 → KCl + 3H2O
4.2. Điều chế kali clorat như vậy nào?
Có nhiều phương pháp để pha trộn Kali Clorat, rõ ràng là:
Đun lạnh lẽo Canxi Clorat với muối bột Kali Clorua ở sức nóng chừng 70 – 75 °C
2KCl + Ca(ClO3)2 ⟶ 2KClO3 + CaCl2
Cho Kali Clorua ứng dụng với Natri Clorat ở ĐK thường
KCl + NaClO3 ⟶ KClO3 + NaCl
Điện phân hỗn hợp Kali Cloria ko vách ngăn nhập ĐK sức nóng chừng 70°C. Phản ứng tiếp tục thực hiện lớp bọt do khí tạo ra H2 xuất hiện tại.
H2O + KCl ⟶ H2 + KClO3
Cho Bari Clorat ứng dụng với Kali iodat ở ĐK thông thường. Phản ứng xẩy ra như sau:
Ba(ClO3)2 + 2KIO3 ⟶ 2KClO3 + Ba(IO3)2
Nhiệt phân Kali hypoclorit nhập ĐK sức nóng chừng 70°C. Phản ứng xẩy ra như sau:
3KClO ⟶ 3KCl + KClO3
4.3. Ứng dụng của Kali clorat – KClO3
- Được trộn láo nháo với tương đối nhiều loại vật tư dễ dàng cháy như lưu hoàng, photpho, bột sắt kẽm kim loại,… nhằm sản xuất dung dịch nổ, phát triển pháo bông, ngòi nổ..
- Dùng nhằm phát triển diêm: Thuốc ở đầu que diêm thông thường chứa chấp ngay sát 50% Kali Clrorat.
- Điều chế oxy nhập chống thử nghiệm bằng phương pháp sức nóng phân KClO3 với xúc tác là MnO2.
- Dùng thực hiện hóa học khử color nhập tết nhuộm và hóa học chống lão hóa.
- Kali Clorat là một trong hóa học đem tính lão hóa cực mạnh, Lúc bị lão hóa tiếp tục hóa giải khí oxy nên nó rất có thể sử dụng như 1 hóa học khử cỏ.
- Tại VN, muối bột Kali Clorat được dùng như 1 hóa học điều tiết cây cối nhập nông nghiệp.
Cho Kali hydroxit KOH ứng dụng với khí Clo ở sức nóng chừng bên trên 80 chừng C. Phản ứng xẩy ra như sau:
3Cl2 + 6KOH ⟶ 3H2O + 5KCl + KClO3
5. Bài luyện vận dụng
Câu 1. Ứng dụng của KClO3 là
A. Chế tạo nên dung dịch nổ, phát triển pháo bông, ngòi nổ và những lếu láo hợp ý dễ dàng cháy không giống.
B. Dùng nhập công nghiệp diêm.
C. Dùng nhằm pha trộn oxi nhập chống thử nghiệm bên dưới dạng phản xạ sức nóng phân và đem hóa học xúc tác là MnO2.
D. Tất cả những đáp án bên trên.
Lời giải:
Đáp án: D
Một số phần mềm của KClO3 là:
- Chế tạo nên dung dịch nổ, phát triển pháo bông, ngòi nổ và những lếu láo hợp ý dễ dàng cháy không giống.
- Dùng nhập công nghiệp diêm.
- Dùng nhằm pha trộn oxi nhập chống thử nghiệm bên dưới dạng phản xạ sức nóng phân và đem hóa học xúc tác là MnO2.
Câu 2. Tổng thông số của toàn bộ những hóa học nhập phương trình sau:
KClO3 KCl + O2
A. 2
B. 4
C. 7
D. 5
Lời giải:
Đáp án: C
PTHH: 2KClO3 2KCl + 3O2
⇒ Tổng thông số là 7.
Câu 3. Khi nói tới kĩ năng phản xạ của oxi, đánh giá sai là
A. Oxi phản xạ thẳng với đa số những sắt kẽm kim loại.
B. Oxi phản xạ thẳng với toàn bộ những phi kim.
C. Oxi nhập cuộc nhập những quy trình xẩy ra sự hóa học, sự han, sự thở.
D. Những phản xạ tuy nhiên oxi nhập cuộc đều là phản xạ lão hóa – khử.
Lời giải:
Đáp án: B
Nhận xét sai là: Oxi phản xạ thẳng với toàn bộ những phi kim.
Vì oxi ko phản xạ thẳng với những halogen
Câu 4. Nhiệt phân trọn vẹn 12,25 g KClO3 thu được khí oxi. Tính thể tích của khí chiếm được ở đktc là
A. 3,36 lít
B. 2,24 lít
C. 3,2 lít
D. 4,8 lít
Lời giải:
Xem thêm: Tháng 6 ẩn chứa điều gì? Mệnh người sinh tháng 6 là gì? Liên kết mạnh mẽ với tháng nào nhất?
Đáp án: A
Vậy = 0,15. 22,4 = 3,36 lít
Câu 5. Cho sơ thiết bị sau: KClO3 + C KCl + X. Chất X là
A. CO2
B. Cl2
C. CO
D. O2
Lời giải:
Đáp án: A
2KClO3 + 3C 2KCl + 3CO2
Câu 6. Cho phương trình phản xạ chất hóa học sau:
2KClO3 + 3C 2KCl + 3CO2
KClO3 đóng tầm quan trọng gì?
A. Chất khử
B. Vừa là hóa học khử vừa vặn là hóa học oxi hóa
C. Chất oxi hóa
D. Chất môi trường
Lời giải:
Đáp án: C
KClO3 đóng tầm quan trọng là hóa học lão hóa bởi số lão hóa của Clo rời kể từ +5 xuống -1.
Câu 7. Cho 1,2 gam C ứng dụng không còn với KClO3 thu được V lít khí X ở đktc. Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 8,96
Lời giải:
Đáp án: A
2KClO3 + 3C 2KCl + 3CO2
= 0,1 mol
V = 0,1. 22,4 = 2,24 lít
Câu 8. Nhỏ kể từ từ hỗn hợp HCl quánh nhập ống thử chứa chấp KClO3 hiện tượng xẩy ra là
A. Không đem hiện tượng lạ gì
B. Xuất hiện tại kết tủa trắng
C. Có khí gold color lục bay ra
D. Có Lúc gray clolor đỏ ối bay ra
Lời giải:
Đáp án: C
6HCl + KClO3 → 3Cl2↑ + KCl + 3H2O
⇒ Có khí gold color lục (Cl2) bay đi ra.
Câu 9. Ứng dụng nào là tại đây không phải của KClO3?
A. Sản xuất diêm.
B. Điều chế oxi nhập chống thử nghiệm.
C. Sản xuất pháo bông.
D. Chế tạo nên dung dịch nổ đen sì.
Lời giải:
Đáp án: D
được phần mềm nhằm sản xuất dung dịch nổ, diêm, phát triển pháo bông, ngòi nổ và những lếu láo hợp ý dễ dàng cháy.
còn được dùng làm pha trộn oxi nhập PTN.
Chọn D bởi bộ phận của dung dịch nổ đen sì là , C và S.
Câu 10. Nhiệt phân trọn vẹn 2,45 g KClO3 chiếm được O2. Cho Zn ứng dụng không còn với lượng oxi vừa vặn chiếm được, tính lượng oxit chiếm được sau phản ứng?
A. 2,45 g
B. 5,4 g
C. 4,86 g
D. 6,35 g
Lời giải:
Đáp án: C
Khối lượng oxit chiếm được sau phản xạ là:
Xem tăng những phương trình chất hóa học khác:
P + KClO3 → KCl + P2O5 | Phường đi ra P2O5
KClO3 + HCl → Cl2 + KCl + H2O | KClO3 đi ra Cl2
Xem thêm: Song Tử hợp với cung nào và hoa gì?
Cl2 + KOH → KCl + KClO3 + H2O | Cl2 đi ra KClO3
KCl + H2O → KOH + H2 + Cl2 | KCl đi ra Cl2
H2SO4 + KCl → HCl + K2SO4 | KCl đi ra HCl
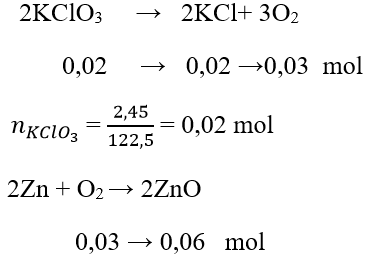











Bình luận